Фетисова Анна Юрьевна / Fetisova Anna Yurievna – учитель биологии, ГБОУ СОШ №250 Кировского района, г. Санкт-Петербург
Аннотация: в статье описывается эксперимент по исследованию аутолитических процессов мозжечка в условиях стресса. Описывается методология количественного и качественного анализа результатов, приводятся результаты обработки экспериментальных данных.
Ключевые слова: мозжечок, фосфолипиды мозга, аутолитические процессы
В последние годы многими отечественными и зарубежными исследователями показано важное значение общих липидов как в нормальном функционировании различных структур головного мозга, так и при ряде патологических процессов, включая мозговую смерть.
Вместе с тем, деградация мозговых структур неразрывно связана с протеканием аутолитических процессов, как в прижизненном, так и в посмертные периоды.
В то же время, близкой по тематике задачей является исследование аутолитических перестроек липидного компонента мозга в стрессовых условиях. Представляемая работа имеет целью раскрытие одного из аспектов этой задачи, а именно изучение описанных процессов, происходящих в мозжечке в условиях экспериментального стресса.
Таким образом, целью данной работы следует считать изучение аутолитических перестроек липидного компонента мозжечка, в условиях экспериментального стресса.
При разработке поставленной проблемы основное место уделялось таким задачам, как обработка общих липидных экстрактов, качественный и количественный анализ ОЛ и ФЛ мозжечка и продолговатого мозга при модели аутолиза НМТ, приготовление ОЛ экстрактов головного мозга стрессированных животных. Можно рассчитывать, что полученные данные послужат ценным материалом для получения практических выводов.
Методы анализа липидов
Получение и очистка общего липидного компонента
Экстакцию и очистку липидов из ткани мозга проводили с использованием метода Блайя и Дайера.
Для этого к одному миллилитру суспензии мозговых структур в среде физраствора добавляли 3,75 мл экстрагирующей смеси (хлороформ, метанол в соотношении 1:2 по объёму), встряхивали и выдерживали не менее 24 часов на холоде, периодически встряхивая. Затем добавляли 1,25 мл хлороформа, смешивали, оставляли на 30 минут и добавляли 1,25 мл воды и снова оставляли стоять в холодильнике на сутки для расслаивания фаз.
После этого отбирали хлороформенный слой с помощью шприца с длинной иглой. Полученный общий липидный экстракт использовали для дальнейшего качественного и количественного анализа липидов.
Количественное определение общих липидов
Определение содержания ОЛ проводили методом разложения с серной кислотой. Для этого 0,1 мл промытого общего липидного экстракта переносили в чистую пробирку и упаривали на водяной бане при температуре +500-600C досуха. К высушенным пробам добавляли 2 мл концентрированной серной кислоты и нагревали в специальном металлическом блоке при температуре 1900-2000C в течение 15-20 минут. Охлаждённые пробы разводили 2 мл дистиллированной воды, перемешивали и (после охлаждения) определяли оптическую плотность на фотоэлектрокалориметре при длине волны 400 нм в кюветах с расстоянием между рабочими гранями 10 мл. Содержание ОЛ и отдельных липидных фракций в пробах рассчитывают пользуясь предварительно построенными калибровочными графиками. В качестве стандартов для построения калибровочных графиков использовали коммерческие препараты липидов фирмы «Sigma». Содержание ОЛ в пробах (в процентах на сырой вес ткани) рассчитывают по формуле: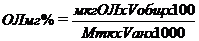 , ,
где:
мкг ОЛ — количество общих липидов в пробе, в микрограммах
Vобщ — общий объём липидного экстракта, в мл.
Mтк — вес ткани, в мг
Vан — объём общего липидного экстракта, взятый для анализа, в мл
100 и 1000 — пересчётные коэффициенты для выражения ОЛ в мг%.
Качественный анализ отдельных липидных фракций методом микротонкослойной хроматографии
Фракционирование ОЛ проводили с использованием метода МТСХ на силикагеле. Для этого 1-1,5 мл общего липидного экстракта упаривали при температуре на выше +500-600C досуха и растворяли в 0,1 мл хлороформа. Полученный раствор служил исходным для проведения МТСХ.
МТСХ проводилась на стеклянных пластинах размером 5x7,5 см. В качестве носителя использовали силикагель «Л» или «ЛС» «Хемапол» из расчёта 20-30 мг на 1 см2 площади пластины. Нанесение сорбента осуществляли методом осаждения его из хлороформа, что значительно сокращает время приготовления пластин. Для получения ровного слоя носителя силикагель взбалтывали в 8-10 мл хлороформа и выливали в чашку Петри, установленную горизонтально, на дно которой помещена стеклянная пластина размером 5x7,5 см.
После осаждения силикагеля и испарения хлороформа пластины высушивали на воздухе или в сушильном шкафу (T = +300-+400С) в течение 10-15 минут. Такой способ нанесения сорбента не требует активации пластинок, поэтому их сразу можно использовать для хроматографии.
Слой силикагеля на пластинках разделяли скальпелем на дорожки (4-5) в зависимости ото числа образцов. Затем на каждую дорожку наносили образец ОЛ (0,01-0,02 мл исходного раствора в хлороформе) на расстоянии 0,3-0,5 см от края пластинки и друг от друга. Посл подсушивания на воздухе проводили разделение в системе растворителей: гексан — диэтиловый эфир — метанол — ледяная уксусная кислота в соотношении 9:2:0,2:0,3 по объёму. В качестве камеры для разделения использовали чашки Петри, на дно которых помещали стеклянные стержни (палочки) для поддержания пластинки. Систему для хроматографии (объём 11,5 мл) вносили в камеру для её насыщения за 10-15 минут до разделения. Подведение системы растворителей к пластинке осуществляли с помощью бумажного фильтра, очищенного от липидных примесей.
После насыщения камеры проводили фракционирование общих липидов. Время прохождения растворителей до края пластинки составляло 5-7 минут, после чего осуществляли поток растворителя ещё в течение 5 минут.
Общее время разделения липидов не больше 10-15 минут. По окончании разгонки пластинку вынимали, сушили на воздухе и проявляли в парах йода. Для этого пластинку переносили в чашку Петри, на дно которой помещали несколько кристалликов йода.
Отдельные классы липидов при этом определялись в виде желтоватых пятен на белом фоне в следующем порядке от места нанесения (старта): фосфолипиды (на старте), холестерин, свободные жирные кислоты, триацилглицерины, эфиры холестерина.
Контуры проявленных фракций очерчивали иглой и пластины оставляли на воздухе до исчезновения йода. Затем механическим путём фракции переносили (счищали) в пробирки.
Элюирование (перевод липидов с силикагеля в раствор) фракций холестерина, свободных жирных кислот, триглицеринов и эфиров холестерина проводили смесью хлороформа с метанолом (3:2 по объёму) дважды по 1 и 2 мл, а фосфолипидов — смесью хлороформа, метанола и 14 н NH4OH (5,6:4,4:0,2 по объёму).
Осадок на фильтре ещё раз промывали 1-1,5 мл соответствующих смесей. Двукратное элоирование практически полностью извлекает сорбированные липиды.
В качестве альтернативного способа применялось центрифугирование в течение 10 минут. Количественное определение отдельных липидных фракций также проводили методом сжигания с концентрированной серной кислотой (см. «Количественное определение общих липидов»).
После определения количественных значений каждой фракции, по их сумме рассчитывают отношение содержания отдельных видов липидов.
Статистическая обработка результатов исследований
Весь полученный цифровой материал обрабатывается статистически по соответствующим биометрическим алгоритмам с использованием функции Стьюдента.
Формулы расчёта:
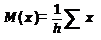
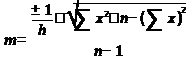
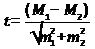
где M(x) — среднее арифметическое значение
h — число исследований
x — единичное значение
m — средняя ошибка средней арифметической
t — показатель существенной разницы
Достоверными считают различия между сравниваемыми величинами при 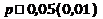
Заключение
Таким образом, исходя из имеющейся информации об особенности строения и структурной организации мозжечка головного мозга крыс, его значения в жизнедеятельности организма, современных представлений об аутолизе, а также на основании данных, полученных из результатов проведённых экспериментов, будет оценено влияние стресса на основные биохимические параметры головного мозга и, в частности, такого его важного отдела, как мозжечка.
Использовался метод получения и очистки общего липидного экстракта, метод количественного определения общих липидов. Для качественного анализа отдельных липидных фракций применялся метод микротонкослойной хроматографии. Для получения общих и конкретных выводов результаты исследований обрабатывают с помощью методов математической статистики.
Результаты статистической обработки
|
№
|
V общ, мл
|
ОЛ сум
|
ФЛ
|
ДГ
|
Х
|
СЖК
|
ТГ
|
ОХ
|
|
1.
|
3,0
|
0,37
|
|
|
|
|
|
|
|
2.
|
3,0
|
0,32
|
|
|
|
|
|
|
|
3.
|
3,0
|
0,34
|
|
|
|
|
|
|
|
4.
|
3,0
|
0,21
|
|
|
0,045
|
0,08
|
|
|
|
5.
|
4,2
|
|
|
|
|
|
|
|
|
6.
|
3,2
|
0,29
|
0,56
|
0,12
|
0,06
|
0,08
|
0,14
|
|
|
7.
|
3,0
|
0,15
|
|
0,14
|
0,035
|
0,055
|
|
|
|
8.
|
4,2
|
0,75+0,41
|
0,37
|
0,11
|
|
0,075
|
0,17
|
0,2
|
|
9.
|
8,6
|
0,1
|
0,15
|
0,13
|
0,055
|
0,1
|
0,119
|
0,35
|
|
10.
|
3,0
|
0,175
|
|
|
|
|
|
|
|
11.
|
3,0
|
0,12
|
|
|
|
|
|
|
|
12.
|
2
|
1,2
|
0,75
|
0,16
|
0,24
|
0,1
|
0,11
|
0,19
|
|
13.
|
2,2
|
0,095
|
0,2
|
0,06
|
0,09
|
0,04
|
0,25
|
0,08
|
|
14.
|
1,8
|
∞
|
1,0
|
0,065
|
0,8
|
∞
|
0,09
|
0,86
|
|
15.
|
2,0
|
0,58
|
0,75
|
0,035
|
0,34
|
0,02
|
0,075
|
0,12
|
|
16.
|
2,2
|
0,17
|
0,46
|
0,24
|
0,045
|
0,045
|
0,075
|
0,12
|
|
17.
|
2,2
|
0,25
|
0,65
|
0,06
|
0,17
|
0,045
|
0,075
|
0,17
|
|
18.
|
2,0
|
0,68
|
0,64
|
0,12
|
0,6
|
0,095
|
0,08
|
0,19
|
|
19.
|
2,0
|
1,0
|
0,44
|
0,08
|
0,8
|
0,13
|
0,07
|
0,16
|
|
20.
|
1,4
|
0,44
|
1,64
|
0,04
|
0,12
|
0,03
|
0,03
|
0,23
|
|
21.
|
3,8
|
0,045
|
0,27
|
0,07
|
0,12
|
0,07
|
0,095
|
0,03
|
|
22.
|
4,0
|
|
0,2
|
0,045
|
0,03
|
0,025
|
0,03
|
0,165
|
|
23.
|
4,0
|
0,075
|
0,35
|
—
|
0,045
|
0,045
|
0,045
|
0,165
|
|
24.
|
3,2
|
0,26
|
0,93
|
–
|
0,21
|
0,07
|
0,04
|
0,165
|
|
25.
|
2,6
|
0,17
|
0,64
|
0,12
|
0,25
|
0,11
|
0,075
|
0,22
|
|
26.
|
2,5
|
0,52
|
0,56
|
0,13
|
0,2
|
0,2
|
0,11
|
0,1
|
|
27.
|
3,0
|
0,44
|
0,95
|
0,17
|
0,37
|
0,09
|
0,17
|
0,24
|
|
28.
|
3,2
|
0,26
|
0,48
|
0,14
|
0,12
|
0,08
|
0,11
|
0,15
|
|
29.
|
2,8
|
0,27
|
0,62
|
0,09
|
0,11
|
0,085
|
0,09
|
0,23
|
|
30.
|
2,0
|
1,5
|
0,48
|
0,12
|
0,44
|
0,095
|
0,2
|
0,11
|
|
31.
|
2,5
|
0,03
|
0,28
|
0,085
|
0,075
|
0,06
|
0,065
|
0,085
|
|
32.
|
3,0
|
0,29
|
|
|
|
|
|
|
|
33.
|
3,0
|
0,16
|
|
|
|
|
|
|
|
34.
|
4,0
|
0,3
|
|
|
0,035
|
0,08
|
|
|
|
35.
|
3,0
|
0,4
|
0,59
|
0,19
|
0,07
|
0,07
|
0,12
|
|
|
36.
|
3,0
|
0,15
|
|
|
|
|
|
|
|
37.
|
3,0
|
0,25
|
|
|
|
|
|
|
|
38.
|
3,0
|
0,35
|
0,31
|
0,05
|
0,03
|
0,02
|
0,1
|
0,17
|
|
39.
|
3,0
|
0,18
|
|
|
|
|
|
|
|
40.
|
3,0
|
0,3
|
|
|
|
|
|
0,11
|
|
41.
|
3,0
|
0,31
|
|
|
|
|
|
|
|
42.
|
4,0
|
0,025
|
0,21
|
0,06
|
0,065
|
0,04
|
0,09
|
0,23
|
|
43.
|
3,0
|
0,175
|
|
|
|
|
|
|
|
44.
|
3,0
|
0,16
|
0,54
|
0,03
|
0,12
|
0,065
|
0,08
|
0,25
|
|
45.
|
3,0
|
—
|
0,24
|
0,05
|
0,045
|
0,06
|
0,13
|
|
|
46.
|
3,0
|
0,27
|
0,77
|
0,035
|
0,22
|
0,1
|
0,09
|
0,25
|
|
47.
|
3,0
|
0,39
|
|
|
|
|
|
|
|
48.
|
2,1
|
|
0,85
|
0,03
|
0,3
|
0,055
|
0,03
|
|
|
49.
|
2,2
|
|
0,58
|
0,05
|
0,3
|
0,015
|
0,06
|
0,12
|
|
50.
|
2,1
|
|
0,45
|
0,07
|
0,13
|
0,04
|
0,05
|
0,13
|
|
51.
|
2,2
|
|
0,3
|
|
0,045
|
0,04
|
0,09
|
0,12
|
|
52.
|
3,8
|
0,05
|
|
|
0,04
|
0,03
|
0,07
|
0,25
|
|
53.
|
2,6
|
0,37
|
0,62
|
0,11
|
|
0,055
|
0,12
|
0,262
|
|
54.
|
7,0
|
0,12
|
0,62
|
0,045
|
0,18
|
0,05
|
0,04
|
0,24
|
|
55.
|
6,0
|
0,065
|
|
0,095
|
0,05
|
0,08
|
|
|
|
56.
|
4,3
|
0,02
|
0,05
|
0,085
|
0,04
|
0,055
|
0,09
|
0,28
|
|
57.
|
2,2
|
0,085
|
0,2
|
0,095
|
0,06
|
0,044
|
0,05
|
0,12
|
|
58.
|
4,8
|
—
|
|
|
|
|
|
|
|
59.
|
2,0
|
0,27
|
0,17
|
0,055
|
∞
|
0,075
|
0,055
|
0,315
|
|
60.
|
2,6
|
0,85
|
0,5
|
0,09
|
0,285
|
0,035
|
0,075
|
0,249
|
|
61.
|
3,2
|
0,15
|
0,07
|
0,04
|
0,075
|
0,04
|
0,075
|
0,095
|
|
62.
|
2,7
|
0,31
|
|
|
|
|
|
|
|
63.
|
4,2
|
0,42
|
|
|
|
|
|
|
|
64.
|
2,6
|
0,5
|
|
|
|
|
|
|
|
65.
|
2,7
|
0,48
|
0,18
|
0,105
|
0,075
|
0,23
|
0,065
|
0,2
|
|
66.
|
6,8
|
0,1
|
|
|
|
|
|
|
|
67.
|
1,8
|
0,82
|
|
|
|
|
|
|
|
68.
|
2,6
|
0,38
|
0,3
|
0,12
|
0,08
|
0,12
|
0,105
|
0,15
|
Литература
1. Брокерхоф Х., Дженсен Р., Липолитические ферменты (пер. с англ.) — М., Мир, 1978
2. Бурин Я., Буренкова О., Хьюстон П. Х. Методики и основные эксперименты по изучению мозга и поведения. — М., Высшая школа, 1991
3. Бурлакова Е. Б. Роль липидов синаптических мембран в передаче и хранении информации — М., 1990
4. Гаевская М. С. Биохимия мозга при умирании и оживлении организма — М., Медгиз, 1963
5. Глеюов Р. Н., Крыжаноский Г. И. Функциональная биохимия синапсов — М., Медицина, 1978
6. Грибанов Г. А. О метаболических взаимоотношениях липидов // Успехи современной биологии — 1979
7. Грибанов Г. А., Бурлакова Е. Б., Гумаргалиева К. З., Ильяшенко Д. В. Новые данные о характере аутолитических изменений липидного компонента различных отделов и ультраструктур головного мозга крыс // Тез. докладов научной конференции профессорско-преподавательского состава — Тверь, 1993
8. Грибанов Г. А., Ильяшенко Д. В. Изменения фосфолипидов серого и белого вещества головного мозга крыс в динамике посмертного аутолиза // Вопросы мед. химии — 1994
9. Дин Р. Процессы распада в клетке — М., Мир, 1981
10. Западнюк Л. П., Западнюк В. И. и др. Лабораторные животные. Разведение, содержание, использование в эксперименте. — М., Высшая школа, 1974
11. Ильяшенко Д. В. Аутолитические изменения липидов различных отделов и и ультраструктур головного мозга крыс. Диссертация кандидата биологических наук — ТвГУ, Тверь, 1996
12. Кейтс М. Техника липидологии. Выделение, анализ и идентификация липидов — М., Мир, 1975
13. Крепс Е. М. Липиды клеточных мембран. Эволюция липидов мозга. Адаптационная функция липидов — М., Наука, 1981
14. Старение мозга (под редакцией Фролькина В. В.) — Л., Наука, 1991
Список сокращений, используемый в работе:
|
ГЛФ
|
Глицерофосфат
|
|
ДГ
|
диацилглицерины
|
|
ДГ-липаза
|
диглицеридлипаза
|
|
ЛФЛ
|
лизофосфолипиды
|
|
МТСХ
|
микротонкослойная хроматография
|
|
НАД(Ф)
|
нитотинамидадениндинуклеотид(фосфат)
|
|
ОЛ
|
общие липиды
|
|
ОФЛ
|
общие фосфолипиды
|
|
ПГФ
|
полиглицерофосфатиды (кардиолипиды)
|
|
Рн
|
фосфат неорганический
|
|
Рлип
|
«липидный» фосфор
|
|
СЖК
|
свободные (неэстерифицированные) жирные кислоты
|
|
СФМ
|
сфингомиелины
|
|
ТГ
|
триацилглицерины
|
|
ФЛ
|
фосфолипиды
|
|
ФЛ-аза
|
фосфолипаза
|
|
ФК
|
фосфоатидные кислоты
|
|
ФС
|
фосфоатидные серии
|
|
ФХ
|
фосфатидилхолины (лецитины)
|
|
ФЭЛ
|
фосфатидилэтаноламины (кефалины)
|
|
Х
|
холестирин
|
|
ЦДФ
|
цитидиндифосфат
|
|
ЦНС
|
центральная нервная система
|
|
ЭПР
|
эндоплазматический ретикулум
|
|
ЭХ
|
эстерифицированный холестерин (эфиры холестерина)
|
|